Grußwort zum 10jährigen Bestehen der MTZstiftung und zur Schirmherrschaft über den MTZ-MPI Award 2016 von der Ministerin für Innovation, Wissenschaft und Forschung NRW Frau Svenja Schulze, Düsseldorf 04.Januar 2017
Foto: MIWFT NRW 2017
Der MTZ-MPI Award 2016 zeigt, dass ein globaler Forschungs-und Bildungsraum zu Spitzenforschung führt.
In Zeiten eines globalen Forschungs- und Bildungsraumes ehrt die MTZstiftung zu ihrem 10jährigen Bestehen erstmals ein internationales Forschungs-Ehepaar. Der Preis steht unter der Schirmherrschaft von der Ministerin für Innovation, Wissenschaft und Forschung NRW Frau Svenja Schulze.
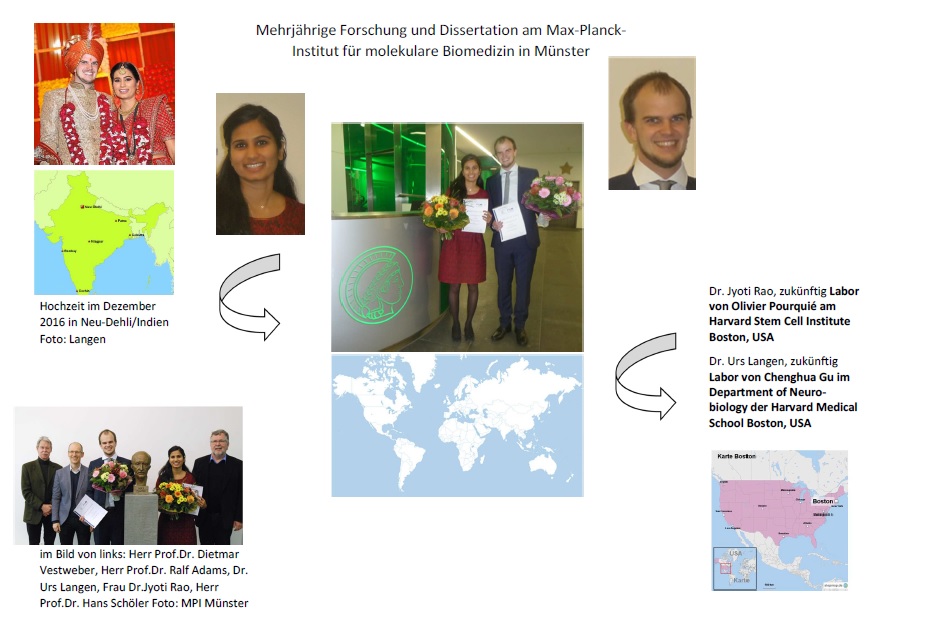
Am 04. Januar 2017 wurde am Max-Planck-Institut für molekulare Biomedizin in Münster als Anerkennung für ihre herausragenden wissenschaftlichen Leistungen der MTZ®-MPI-Award 2016 gemeinsam an Frau Dr.rer.nat. Jyoti Rao und Herrn Dr.rer.nat. Urs Langen verliehen. Die Auszeichnung ist mit 2.500 € dotiert und soll den Preisträgern ermöglichen, ihre Forschungsarbeiten durch Aufbau- und Ergänzungsstudien sowie Praktika im Ausland voran zu treiben.
"...Es gibt heute mehr als einen Anlass zu gratulieren:
2016 feierte die MTZ®stiftung ein rundes Jubiläum. Seit zehn Jahren fördert die Stiftung junge Nachwuchswissenschaftlerinnen und Nachwuchswissenschaftler, die sich für ein Leben bei bestmöglicher Gesundheit und ein Altern in Würde einsetzen. Als innovative Netzwerkorganisation fördert sie den Austausch und die Zusammenarbeit von Forscherinnen und Forschern.
Heute werden eine Forscherin und ein Forscher ausgezeichnet, die sich schon sehr früh in ihrer wissenschaftlichen Laufbahn einen Namen gemacht haben: Mit ihren Arbeiten zur Herzmuskelentwicklung und Knochenbildung haben Frau Dr. Rao und Herr Dr. Langen bedeutende Beiträge zur Erforschung von Krankheiten und zur Entwicklung von Therapien geleistet.
Zu all diesen Anlässen sende ich Ihnen meine Glückwünsche. Ich finde es sehr schade, dass ich nicht persönlich an diesen Feierlichkeiten teilnehmen kann. ... Ich danke Ihnen sehr herzlich für Ihr langjähriges Engagement. Mit den MTZ-Awards unterstützen Sie Nachwuchswissenschaftlerinnen und Nachwuchswissenschaftler, die sich schon in jungen Jahren in ihrem Fachgebiet ausgezeichnet haben. Jahr für Jahr entdecken und fördern Sie talentierte Wissenschaftlerinnen und Wissenschaftler, die die Preise aufgrund Ihrer wissenschaftlichen Expertise verdienen. Dafür sorgen auch unsere hervorragenden Forschungseinrichtungen wie das Max-Planck-Institut für molekulare Biomedizin in Münster, die maßgeblich zum wissenschaftlichen Fortschritt in der Systembiologie und der personalisierten Medizin beitragen.
Ich danke Ihnen allen für Ihre engagierte Arbeit und wünsche Ihnen eine schöne Veranstaltung, anregende Gespräche und viele weitere erfolgreiche Jahre der MTZ-Stiftung."

Dr. Jyoti Rao: In zwei Schritten zu Herzmuskelgewebe
Aus pluripotenten Stammzellen erzeugtes Herzmuskelgewebe gewinnt für die Biomedizin zunehmend an Bedeutung. Dabei versuchen Forscher, die natürlichen Prozesse im frühen Embryo nachzuahmen. Durch Erkenntnisse der Entwicklungsbiologie haben sie zwar Hinweise, welche Gene bei diesen Prozessen eine Rolle spielen, doch wie die Differenzierung in Herzmuskelgewebe gesteuert wird, war bislang weitgehend unbekannt. Dr. Jyoti Rao, Mitarbeiterin in der Forschungsgruppe von PD Dr. Boris Greber am Max-Planck-Institut für molekulare Biomedizin, hat diesen Mechanismus in menschlichen Zellen entschlüsselt. Vor allem bei der Anwendung von aus Patientenzellen gewonnenen Herzmuskelzellen für die Krankheits- und Medikamentenforschung sind diese Ergebnisse von hoher Relevanz.
Die Frage, wie ein Embryo alle Zelltypen des menschlichen Körpers kreiert, fasziniert schon seit ewigen Zeiten. Ähnlich wie die Zellen im frühen Embryo, sind menschliche embryonale Stammzellen (hES-Zellen) pluripotent, d.h. sie können sich in alle Zelllinien des menschlichen Körpers differenzieren; z. B. in Herzmuskelzellen, Nervenzellen oder Leberzellen. Mit Wissen aus embryologischen Studien in anderen Modellsystemen können durch gezielte Änderungen der externen Umgebung hES-Zellen in einer Petrischale in einen bestimmten Zelltypen differenziert werden. Umgekehrt können Protokolle zur hES-Zelldifferenzierung sehr gut als in vitro-Instrument für die Studie der menschlichen Embryologie verwendet werden.
Die Bildung von Herzmuskelzellen aus hES-Zellen verläuft stufenweise, wobei die Zellen bei jedem Schritt einerseits an Potenz einbüßen, dafür aber immer spezifizierter werden – bis sie zum Schluss schlagende Herzmuskelzellen sind. Der erste Schritt, vom pluripotenten Stadium zu einem Mesoderm-ähnlichen Status, geschieht durch die Aktivierung zweier Signalwege: BMP und WNT. Interessanterweise erfordert der zweite Schritt zu einem weiter spezifizierten Status die Hemmung des WNT-Signalweges. Obwohl man durch Eingriffe in diese Signalwege schlagende Herzmuskelzellen generieren konnte, war nicht bekannt, welche Rolle diese Signalwege tatsächlich spielen. In ihrer Doktorarbeit hat Dr. Jyoti Rao die Differenzierungsprozesse von hES-Zellen in Herzmuskelzellen intensiv untersucht und die genomweiten, molekularen Effekte, die diese Signalwege auslösen, bis ins Detail untersucht. Jyoti Rao und ihre Kollegen haben herausgefunden, dass die beiden Signalwege in einer kooperativen Art bestimmte Transkriptionsfaktoren blockieren. Diese Transkriptionsfaktoren fungieren als Repressoren der Herzmuskelzell-Differenzierung. Wenn sie nicht blockiert werden, würden sie die Zellen zur Differenzierung in andere Zelltypen umlenken. Ihre Ergebnisse zeigen deutlich, dass sich die Differenzierungswege während der embryonalen Entwicklung mehrfach in verschiedene Richtungen gabeln, wobei jede Gabelung durch eine bestimmte Kombination und Dosis molekularer Signale kontrolliert wird.
Diese Arbeiten haben ein Licht auf die Grundlagen der frühen humanen Embryonalentwicklung geworfen. Das Verständnis solcher Grundlagen wird weitere Methoden vorantreiben, mit der Zellen in einem Zwischenstadium, womöglich mit einem vermehrenden Charakter, stabilisiert werden können. Kenntnisse der richtigen molekularen Signale und deren nachgeschalteter Effektorproteine könnten für die Optimierung von Differenzierungsprotokollen für die Verwendung in Pharmakologie, Zelltherapie und Krankheitsmodellen von großem Nutzen sein.
Jyoti Rao (28) machte ihren Bachelor Abschluss in Zoologie und ihren Master Abschluss in Genetik an der Universität von Delhi, Indien. Ihre Doktorarbeit absolvierte sie unter der Betreuung von PD Dr. Boris Greber, Leiter der Forschungsgruppe Human Stem Cell Pluripotency Laboratory am Max-Planck-Institut für molekulare Biomedizin. Jyoti Raos Poster wurden auf wissenschaftlichen Konferenzen vielfach ausgezeichnet. Sie ist Erstautorin von drei wissenschaftlichen Publikationen – die wohl bedeutendste erschien in Cell Stem Cell – und Co-Autorin von drei weiteren Publikationen. Jyoti Rao wird als Postdoktorandin im Labor von Olivier Pourquié am Harvard Stem Cell Institute in Boston, USA, arbeiten.
Dr. Urs Langen: Knochenharter Job für Endothelzellen
Die Erforschung von Knochen ist technisch sehr schwierig. Folglich ist nur wenig über die genauen Mechanismen von Knochen- und Gefäßbildung bekannt. In einem Wissenschaftler-Team um Ralf H. Adams vom Max-Planck-Institut für molekulare Biomedizin hat Dr. Urs Langen die technischen Schwierigkeiten überwinden können und Färbungsmethoden für Knochenpräparate entwickelt. Dadurch haben die Wissenschaftler einen neuen Typ von Blutgefäßen im Knochen entdeckt, der die Knochenbildung fördert. Diese Ergebnisse könnten für die Entwicklung von zukünftigen Therapien für Knochenbrüche und Knochenschwund von großem Nutzen sein.
Blutgefäße ermöglichen nicht nur den Transport von Sauerstoff, Nährstoffen und Hormonen, sondern sie transportieren auch Kohlendioxid, Abfallprodukte und Gifte aus unserem Körper heraus. Blutgefäße sind keine starren Röhren, sondern bilden ein lebendiges Netzwerk, das von Endothelzellen ausgekleidet wird. Diese Zellen modulieren die Eigenschaften der Gefäße; sie sind sehr anpassungsfähig und bedienen damit den individuellen Bedarf der einzelnen Organe. Zudem haben neue Studien gezeigt, dass Endothelzellen auch Wachstums-, Strukturbildungs- und Regenerationsprozesse im umliegenden Gewebe steuern.
Wissenschaftler vermuteten schon länger, dass eine molekulare Verbindung zwischen Endothelzellen und knochenbildenden Zellen (Osteoblasten) existiert. Die genauen molekularen und zellulären Verflechtungen dieser Prozesse waren jedoch bislang unbekannt. Ebenso wenig war klar, wie das Netzwerk der Knochengefäße überhaupt aufgebaut ist. Diese Wissenslücke hat einen technischen Hintergrund: Der Knochen ist stark kalzifiziert und reich an Matrix, weshalb bildgebende Verfahren vorherige Dekalzifizierung und andere Arbeitsschritte erfordern. Diese Schritte können jedoch das Gewebe zerstören und so wichtige Details verschleiern. Wissenschaftler in der Abteilung von Ralf Adams haben Verfahren für die Knochenaufbereitung entwickelt, bei denen die feinen anatomischen Strukturen erhalten bleiben und visualisiert werden können.
In seiner Doktorarbeit hat Dr. Urs Langen entdeckt, dass sich die Architektur von Blutgefäßen im Knochen während der Entwicklung stark ändert. Während bestimmte Kapillaren die umliegenden Vorläuferzellen von knochenbildenden Zellen unterstützt, ist ein zweiter Typ von Kapillaren an Zellen des blutbildenden (hämatopoetischen) Systems gekoppelt. Die verschiedenen Arten von Blutgefäßen treten in bestimmten Bereichen des Knochens, haben verschiedene morphologische Eigenschaften und ihre Endothelzellen können mit Hilfe spezifischer Marker durch Durchflusszytometrie von einander separiert werden. Mit dieser Methode hat Urs Langen eine dritte Population Endothelzellen im Knochen identifiziert, welche während der Knochenbildung in sehr frühen Entwicklungsstadien zu finden sind. Mittels hochmoderner RNA-Sequenzierung fand er heraus, dass diese Population sogar noch stärker die osteoblastische Differenzierung antreibt, was wahrscheinlich ein schnelles Knochenwachstum im embryonalen und postnatalen Organismus begünstigt. Urs Langen zeigte zudem, dass die Spezifizierung von Gefäß- und Endothelzelltypen im wachsenden Knochen durch Interaktionen mit der extrazellulären Matrix kontrolliert wird.
Diese Entdeckungen ebnen den Weg für neuartige Therapien von Krankheiten mit defekter Knochenbildung. Denn wenn die Mechanismen bekannt sind, welche die Entstehung von solchen Endothelzellen und damit das Knochenwachstum begünstigen, dann könnte möglicherweise auch die Bildung von Knochen in verschiedenen humanen Erkrankungen angeregt werden.
Urs Langen (32) studierte Biochemie an der Universität von Tübingen in Deutschland. Seine Doktorarbeit absolvierte er in der Abteilung Gewebebiologie und Morphogenese am Max-Planck-Institut für molekulare Biomedizin. Urs Langen ist Autor bzw. Koautor von drei Manuskripten, die veröffentlicht oder in Begutachtung sind. Er wird seine wissenschaftliche Karriere als Postdoktorand im Labor von Chenghua Gu im Department of Neurobiology der Harvard Medical School in Boston, USA, fortsetzen.

